分子轨道(MO)理论:
R.S.Mulliken由于建立和发展MO理论荣获1966年诺贝尔化学奖。分子轨道(MO)是原子轨道在分子体系中的推广。
分子轨道理论处理氢分子离子的结果:
H2+的能量如下式:
EI=1+S12H11+H12EII=1−S12H11−H12
EI是基态能量,对应基态波函数。EII是激发态能量,对应激发态波函数。
EI和EII均是核间距R的函数,能量随R变化曲线如下图:
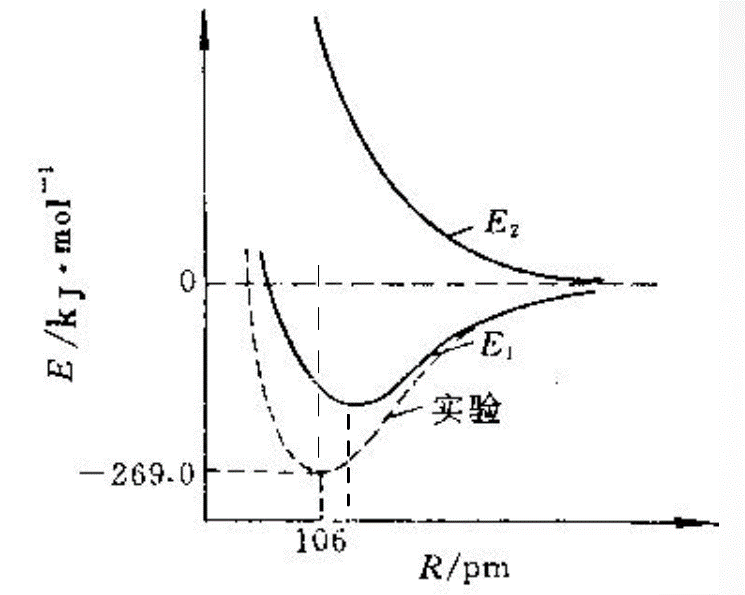
实验测得R=106pm时,EI有最小值−269.0kJ/mol。
电子云密度与共价键本质:
在H2+的基态,核间的电荷密度增大,电子同时受到两个核的吸引,由于这种吸引使得体系能量降低,使具有一定稳定性的共价键形成。在分子轨道理论中称为成键轨道。
在H2+的激发态,核间电荷密度变小,体系能量升高,所以称为反键轨道。
